Ligações Químicas
Teoria do Octeto
Um grande número de elementos adquire estabilidade eletrônica quando seus átomos apresentam oito elétrons na sua camada mais externa.
Existem excessões para essa teoria como o Hidrogênio (H) e o Hélio (He), onde ambos se estabilizam com dois elétrons na última camada.
Ligações Iônicas ou Eletrovalentes
Na ligação iônica há a formação de íons devido a transferência de elétrons de um átomo para o outro. Normalmente, nesta ligação, existe um elemento que tende a ceder elétrons (metal - cátion), e outro que tende a receber elétrons (não metal - ânion).
Obs: A ligação iônica é a única em que ocorre a transferência de elétrons.
Exemplo: A configuração eletrônica do Sódio e do Cloro segundo o diagrama de Linus Pauling fica do seguinte modo:
11Na 1s2 2s2 2p6 3s1
17Cl 1s2 2s2 2p6 3s2 3p5
O sódio possui 1 elétron na última camada. Basta perder este elétron para que ele fique estável com 8 elétrons na 2ª camada.
O cloro possui 7 elétrons na última camada. É bem mais fácil ele receber 1 elétron e ficar estável do que perder 7 elétrons para ficar estável, sendo isto o que acontece.
Agora tudo está perfeito. O sódio quer doar 1 elétron e o cloro quer receber 1 elétron. Eles se aproximam e o sódio doa seu elétron que está em excesso e o cloro o recebe.
Veja o esquema abaixo:
Como obter a fórmula de um composto iônico? Simples! Basta saber a carga do cátion e do ânion e invertê-las, colocando-as como quantidade de átomos de cada elemento no composto. Tá complicado ainda? Veja no exemplo abaixo como isso é simples:
Composto: Óxido de alumínio
Distribuição eletrônica: Oxigênio (O): Z = 8
K (2), L (6)
Alumínio (Al): Z = 13
K (2), L (8), M (3)
O átomo de oxigênio precisa ganhar 2 elétrons: O-2
O átomo de alumínio precisa perder 3 elétrons: Al-3
Fórmula do composto: Al2O3
Principais propriedades dos compostos iônicos:
• Têm alto ponto de fusão e ebulição;
• Quando dissolvidos em água ou fundidos, conduzem corrente elétrica;
• São sólidos e apresentam, nas condições ambientes, um retículo cristalino.
Os compostos iônicos estão em toda parte. O vidro, por exemplo, é feito com compostos iônicos. Assista à animação abaixo e aprenda mais sobre a ligação iônica!
LIGAÇÃO COVALENTE
Vimos antes,sobre ligação iônica, que o composto cloreto de potássio se forma porque o átomo do potássio cede um elétron para o átomo do cloro, ficando ambos com oito elétrons na camada de valência. Mas você deve saber que o gás oxigênio é formado por dois átomos do elemento oxigênio (O2).
Deve lembrar também que este elemento tem número atômico 16 e que, portanto, possui 6 elétrons na sua última camada. Ora, podemos concluir então que o átomo de oxigênio, para adquirir estabilidade, precisa ganhar mais 2 elétrons. É isso mesmo! Mas, se é assim, então como que dois átomos de oxigênio podem se ligar para formar o nosso famoso e abundante gás oxigênio?!
Assim como o gás oxigênio muitos outros compostos estão na mesma situação, o que nos leva à conclusão de que os elementos desses compostos estão ligados por outro tipo de ligação na qual não pode haver transferência de elétrons.
A este outro tipo de ligação damos o nome de ligação covalente. A ligação covalente consiste no compartilhamento de um ou mais elétrons entre átomos. Preste bem atenção nisso! Enquanto na ligação iônica há transferência de elétrons, na ligação covalente há compartilhamento de elétrons. Como isso ocorre? Simples! Se você tem irmãos e na sua casa só tem um computador, você sabe bem o que é compartilhar!
Ligação iônica
Ligação Covalente
Voltando ao gás oxigênio, é assim que ele se forma, a partir do compartilhamento de dois dos seus elétrons. É compartilhando um par de elétrons que ambos os átomos de oxigênio se mantém unidos e estáveis. A ligação covalente geralmente ocorre entre átomos de eletronegatividade similares e altas (nestes é muito difícil remover elétrons porque isso demandaria muita energia). É por isso que a ligação covalente ocorre entre os não-metais, podendo acontecer, ainda, entre um não-metal e o hidrogênio e entre hidrogênio e hidrogênio.
Você deve saber que o hidrogênio só tem 1 elétron e que, portanto, não pode doar esse seu único elétron e ficar sem nada. É mais ou menos como ter apenas um rim, você não pode doar ele pra ninguém, a menos que queria abrir mão da sua vida. Imaginou a situação? Bom, então você já sabe como o hidrogênio se sente...
Agora, você acha que será fácil tirar um elétron do átomo de hidrogênio? Mas nem se estivesse valendo o Prêmio Nobel do Altruísmo! Por outro lado, você deve saber que a água que você bebe e que corresponde a cerca de 75% dos constituintes do seu corpo (o cérebro é constituído de 85% de água, logo, vestibular sem água não dá, cara!) é formada por dois átomos de hidrogênio mais um átomo de oxigênio (H2O). Logo, se o oxigênio precisa ganhar dois elétrons e se os átomos de hidrogênio não vão ceder esses elétrons nem sob tortura, o jeito então é: compartilhar! Sim, os átomos da molécula de água são atraídos por meio da ligação covalente.
A ligação covalente pode ser demonstrada por meio da representação eletrônica de Lewis ou pela representação estrutural. Exemplos:
Representação de Lewis (eletrônica)
Representação estrutural
LIGAÇÃO COVALENTE DATIVA
Agora que você já sabe o que é a ligação covalente, pense no SO2. Sabemos que tanto o enxofre quanto o oxigênio pertencem ao grupo 16 da tabela periódica, tendo, portanto, 16 elétrons. Fazendo a distribuição eletrônica dos seus elétrons vamos descobrir que ambos os elementos possuem 6 elétrons na sua última camada, precisando, para completarem sua camada de valência e ficarem estáveis, de mais dois elétrons.
Já que ambos precisam de um par de elétrons, então o jeito é que esses dois elementos compartilhem os elétrons que faltam. Um átomo de enxofre compartilha um par de elétrons com um átomo de oxigênio, como demonstrado abaixo:
Mas e o outro átomo de oxigênio da molécula?! Se o átomo de enxofre já está completo e um dos átomos de oxigênio também, onde entra o outro átomo de oxigênio? Pois é, algumas moléculas não podem ser explicadas somente pela ligação covalente. Por isso foi formulada a teoria de que há um tipo especial de ligação covalente, que foi chamada de ligação covalente dativa ou ligação coordenada.
A ligação covalente dativa ocorre exatamente da mesma forma que a covalente simples, a única coisa que as diferencia é a procedência do par de elétrons compartilhado, que vem apenas de um dos átomos. Em outras palavras, na ligação covalente dativa um átomo com a camada de valência já completa compartilha elétrons com outro átomo de última camada ainda incompleta. Esse sim é um exemplo genuíno de solidariedade: ajudar ao próximo sem esperar nada em troca!
A ligação covalente dativa é representada por uma seta que parte do átomo que doa seus elétrons para compartilhar e vai até o átomo que recebe. Veja esta representação mais claramente no exemplo abaixo:
O mesmo procedimento deve ser usado na representação estrutural:
*Sobre ligação covalente simples e dativa: as ligações covalentes podem formar compostos sólidos, líquidos ou gasosos.
Vamos ver mais um exemplo de ligação covalente dativa. Como fica a representação eletrônica e a estrutural do oxiácido ácido sulfúrico (H2SO4)?
Comece a montar a fórmula estrutural pelo átomo central. Depois você coloca o hidrogênio ligado a um oxigênio que estará ligado ao átomo central. Lembre-se que tanto o enxofre quanto o oxigênio pertencem à família 6A e que, portanto, têm 6 elétrons na última camada.

Temos, ainda, mais um átomo de hidrogênio. Ele também deve se ligar a um átomo de oxigênio, e este ao átomo de enxofre:
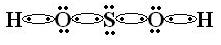
Pronto, os átomos já estão todos com a camada de valência completa. Mas, se você observar a fórmula molecular do ácido sulfúrico (H2SO4), vai ver que na nossa fórmula eletrônica faltam ainda 2 oxigênios. Se todos os átomos já estão com a última camada completa, então, resta aos outros dois oxigênios que faltam ligar-se por meio da ligação covalente dativa! A quem se liga o oxigênio? Ao átomo central! Veja como fica:

Viu como é simples! Agora fica fácil montar a representação estrutural:
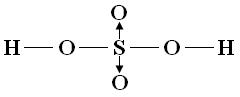
Fonte: Uol Educação






Nenhum comentário:
Postar um comentário